Cara Membedakan Larutan Elektrolit Dan Non Elektrolit, Anda dapat melakukan beberapa pengamatan dan uji sederhana.
Larutan Non Elektrolit
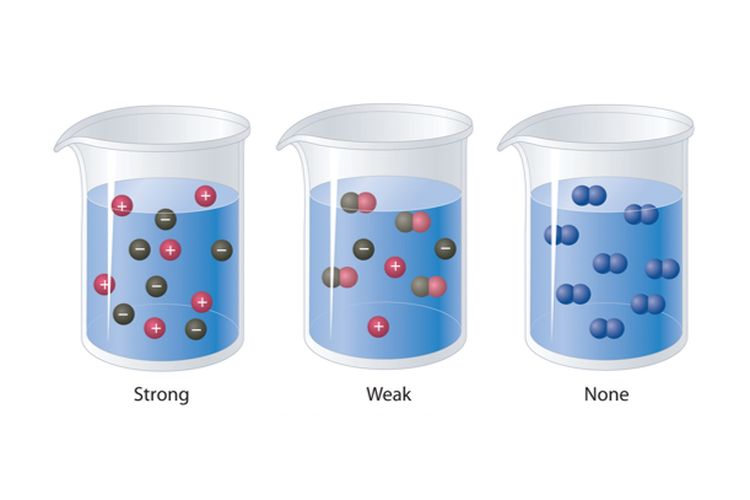
Larutan elektrolit adalah larutan yang mengandung ion-ion bermuatan listrik (positif dan negatif) yang dapat menghantarkan listrik saat larutan tersebut larut dalam pelarut. Ion-ion ini berasal dari zat yang larut dalam larutan tersebut.
Secara umum, terdapat dua jenis larutan elektrolit berdasarkan seberapa banyak ion yang dihasilkan saat larutan tersebut larut:
1. Larutan Elektrolit Kuat : Larutan elektrolit kuat merupakan larutan yang menghasilkan banyak ion bermuatan saat larut dalam pelarut. Contoh larutan elektrolit kuat termasuk larutan garam meja (seperti NaCl), larutan asam kuat (seperti HCl), dan larutan basa kuat (seperti NaOH). Ketika larutan elektrolit kuat larut dalam air, zat-zat tersebut sepenuhnya terionisasi menjadi ion-ion (seperti Na⁺, Cl⁻, H⁺, OH⁻).
2. Larutan Elektrolit Lemah : Larutan elektrolit lemah merupakan larutan yang hanya menghasilkan sejumlah kecil ion bermuatan saat larut dalam pelarut. Contoh larutan elektrolit lemah termasuk asam lemah (seperti asam asetat), basa lemah (seperti NH₃), dan garam yang ionisasinya tidak sepenuhnya (seperti asam asetat dalam air). Ketika larutan elektrolit lemah larut dalam air, hanya sebagian zat-zat tersebut yang terionisasi menjadi ion-ion.
Ketika larutan elektrolit diuji dengan alat penghantar listrik (seperti konduktometer), larutan elektrolit akan menunjukkan kemampuan untuk menghantarkan listrik yang lebih baik dibandingkan dengan larutan non-elektrolit atau larutan yang mengandung ion-ion dalam konsentrasi rendah.
Dalam larutan elektrolit, ion-ion bermuatan memungkinkan larutan untuk menghantarkan arus listrik karena ion-ion ini dapat bergerak secara bebas di dalam larutan. Larutan elektrolit sangat penting dalam kimia dan fisika karena sifat konduktivitasnya yang berguna dalam banyak aplikasi, termasuk dalam elektrokimia, proses industri, dan proses biologis di dalam tubuh manusia.
Larutan Elektrolit
Larutan non-elektrolit adalah larutan yang tidak mengandung ion-ion bermuatan listrik yang dapat menghantarkan listrik saat larutan tersebut larut dalam pelarut. Dalam larutan non-elektrolit, zat-zat yang larut akan tetap dalam bentuk molekul atau partikel netral, tanpa terionisasi menjadi ion positif (kation) dan ion negatif (anion).
Contoh umum dari larutan non-elektrolit termasuk larutan gula (sukrosa), larutan alkohol (misalnya etanol), dan larutan urea. Ketika larutan non-elektrolit larut dalam air, molekul-molekul tersebut tetap utuh dan tidak terionisasi menjadi ion-ion.
Beberapa ciri-ciri larutan non-elektrolit meliputi:
1. Tidak Menghantarkan Listrik : Larutan non-elektrolit tidak dapat menghantarkan listrik karena tidak memiliki ion bermuatan bebas yang dapat bergerak untuk membawa arus listrik.
2. Tidak Mengalami Elektrolisis : Ketika diberi arus listrik, larutan non-elektrolit tidak akan mengalami elektrolisis atau pemisahan zat menjadi ion-ion.
3. Stabilitas Molekul : Zat-zat dalam larutan non-elektrolit tetap dalam bentuk molekul atau partikel netral dan tidak berdisosiasi menjadi ion-ion saat larut dalam pelarut seperti air.
Meskipun larutan non-elektrolit tidak menghantarkan listrik, mereka tetap memiliki peran yang penting dalam berbagai aplikasi kimia, farmasi, dan biologi. Contohnya, larutan gula sering digunakan dalam pembuatan sirup, minuman, dan makanan manis lainnya. Larutan non-elektrolit juga digunakan dalam proses kimia dan dalam berbagai proses industri di mana konduktivitas listrik tidak diinginkan atau tidak diperlukan.
Cara Membedakan Larutan Elektrolit Dan Non Elektrolit
Untuk membedakan larutan elektrolit dan non-elektrolit, Anda dapat melakukan beberapa pengamatan dan uji sederhana. Berikut adalah langkah-langkahnya:
1. Pengamatan Kelarutan
– Larutan Elektrolit : Larutan elektrolit biasanya dapat menghantarkan listrik dengan baik. Jika Anda menggunakan lampu pijar atau alat penghantar listrik sederhana (seperti penghantar listrik kecil yang ditempelkan ke baterai atau sumber listrik), larutan elektrolit akan menghasilkan sedikit cahaya atau mengalirkan arus listrik, menunjukkan bahwa partikel-partikel bermuatan (ion) hadir dalam larutan.
– Larutan Non-Elektrolit : Larutan non-elektrolit biasanya tidak menghantarkan listrik. Ketika Anda mencoba mengalirkan listrik melalui larutan non-elektrolit menggunakan alat penghantar listrik, tidak akan ada cahaya yang dihasilkan dan aliran listrik tidak terdeteksi, menunjukkan bahwa larutan ini tidak memiliki partikel bermuatan bebas (ion) yang dapat menghantarkan listrik.
2. Pengamatan Perilaku Larutan
– Larutan Elektrolit : Larutan elektrolit seringkali dapat mengalami elektrolisis (penguraian oleh arus listrik) dan memproduksi gas atau menghasilkan reaksi kimia yang terlihat dengan jelas. Misalnya, larutan elektrolit dapat memisahkan zat menjadi gas atau endapan saat dialiri arus listrik.
– Larutan Non-Elektrolit : Larutan non-elektrolit biasanya tidak akan mengalami reaksi elektrolisis. Ketika larutan non-elektrolit terkena arus listrik, tidak akan ada pemisahan zat, perubahan warna, atau pembentukan gas.
3. Uji Konduktivitas Listrik
– Larutan Elektrolit : Anda dapat menggunakan alat pengukur konduktivitas listrik (misalnya, konduktometer) untuk mengukur kemampuan larutan dalam menghantarkan listrik. Larutan elektrolit akan memiliki konduktivitas listrik yang lebih tinggi dibandingkan dengan larutan non-elektrolit.
4. Uji Pemisahan Zat
– Larutan Elektrolit : Larutan elektrolit akan dapat memisahkan zat (seperti elektrolisis air menjadi gas hidrogen dan oksigen) jika dialiri arus listrik.
Contoh Uji Sederhana
Sebagai contoh, Anda dapat mencoba uji dengan menggunakan larutan garam (contoh larutan elektrolit) dan larutan gula (contoh larutan non-elektrolit):
– Tambahkan lampu pijar ke dalam larutan garam dan larutan gula.
– Lampu pijar akan menyala terang dalam larutan garam (menunjukkan larutan elektrolit).
– Lampu pijar tidak akan menyala dalam larutan gula (menunjukkan larutan non-elektrolit).
Dengan mengamati dan melakukan uji sederhana seperti ini, Anda dapat membedakan antara larutan elektrolit dan non-elektrolit. Perhatikan bahwa ini adalah langkah-langkah umum dan uji sederhana; untuk pengujian yang lebih akurat, Anda dapat menggunakan peralatan laboratorium yang lebih canggih.
Sekian Cara Membedakan Larutan Elektrolit Dan Non Elektrolit, Semoga Bermanfaat. Baca Juga Cara Membedakan Soflen Kanan Dan Kiri